mikroRNA mohou zlepšit diagnostiku fibromyalgie a ME/CFS
Fibromyalgie (FM) a myalgická encefalomyelitida/chronický únavový syndrom (ME/CFS) jsou chronické zdravotní stavy neznámé etiologie, které jsou doprovázeny četnými příznaky ovlivňujícími neurologický a fyzický stav. Sdílejí mnoho dysregulovaných biologických nebo molekulárních procesů, které mohou přispívat k jejich společným příznakům. Navzdory častým revizím diagnostických kritérií, nedostatečným lékařským vzdělávacím programům a zastaralým pokynům pro praktické lékaře nejsou tato onemocnění přesně diagnostikována, což negativně ovlivňuje nejen kvalitu života pacientů, ale také související náklady vynaložené zdravotnickými systémy.
Je naléhavě zapotřebí biomarkerů, které by dokázaly účinně odhalit tato onemocnění v raném stadiu a přispět k účinné personalizované léčbě, jež by zmírnila bolest a zlepšila klinický stav pacientů.
miRNA jsou krátké (18-21 nukleotidů) nekódující molekuly RNA známé jako hlavní regulátory genové exprese, které kontrolují více než 60 % lidského genomu, vážou se na specifickou sekvenci v 3 nepřekládané oblasti (3-UTR) svých cílových genů a vyvolávají translační represi. miRNA regulují širokou škálu buněčných a biologických procesů. Některé miRNA byly navrženy jako slibné biomarkery pro mnoho patologických stavů. Existují důkazy o aberantní expresi miRNA u chronických onemocnění. Identifikace kandidátních biomarkerů miRNA zapojených do základních mechanismů těchto chronických únavových syndromů má velký význam.
Na patologických mechanismech, jež jsou základem těchto onemocnění, se podílejí dysregulované mikroRNA (miRNA), které mohou posloužit při diagnostikování. Autoři této studie vybrali z relevantních publikací miRNA (miR-23a, miR-103, miR-152 a miR-320), které jsou spojeny s patofyziologickými procesy těchto chronických onemocnění. A miR-29c, miR-99b, miR-128, miR-374b a miR-766 pro svou roli v imunitní odpovědi, mitochondriální dysfunkci, oxidačním stresu a centrální senzibilizaci.
ME/CFS a FM mají společné příznaky přetrvávající vysilující únavy a chronické bolesti, které jsou lékařsky nevysvětlitelné déle než 3 měsíce v případě FM a déle než 6 měsíců v případě ME/CFS. U těchto chronických onemocnění byly popsány multisystémové příznaky, včetně extrémní únavy, myalgie (bolesti svalů a kloubů), malátnosti po námaze (PEM), mozkové mlhy, kognitivní dysfunkce, poruch spánku, úzkosti, deprese, poruch nálady a gastrointestinálních poruch. Na základě diagnostických kritérií Institute of Medicine (IOM) pro ME/CFS (2015) jsou předpokladem diagnózy tři příznaky (extrémní únava, PEM a poruchy spánku) a alespoň jeden ze dvou dalších projevů (kognitivní porucha a ortostatická intolerance). Co se týče diagnózy FM, podle diagnostických kritérií American College of Rheumatology (ACR) (2016) by měla být zjištěna oboustranná bolest na levé i pravé straně těla nad i pod pasem a chronická generalizovaná bolest (na krční páteři, přední straně hrudníku, hrudní páteři nebo v dolní části zad) v nejméně 11 z 18 citlivých bodů. Na vzniku těchto chronických onemocnění se podílí několik rizikových faktorů. Patří mezi ně genetická a rodinná predispozice, faktory životního prostředí související s toxiny, toxickými kovy, (zemědělské) chemikálie a virové a bakteriální infekce. Kromě toho mohou hrát významnou roli také autoimunita, stresové stavy a nedostatky ve výživě.
Velké množství důkazů o možných patologických mechanismech, které jsou základem ME/CFS nebo FM, podporuje názor, že u těchto chronických únavových onemocnění může hrát roli dysregulace více systémů - centrálního nervového systému (CNS), imunitního systému, metabolismu a transportu iontů.
Dysregulované biologické a buněčné procesy společné pro ME/CFS a FM
Četné studie ukázaly, že abnormální změny v imunitním systému, chronické zánětlivé dráhy a dráhy oxidativního stresu, mitochondriální dysfunkce, snížená funkce cév, metabolismus tryptofanu, porucha iontových kanálů přechodného receptorového potenciálu (TRP) a centrální senzibilizace se mohou podílet jak na ME/CFS, tak na FM. Mimoto se také uvádějí změny v autonomním a neuroendokrinním systému zahrnující osu hypotalamus-hypofýza-nadledviny (HPA), aktivace buněčných signálních sítí a poruchy metabolických drah. Tyto faktory přispívají k běžným příznakům těchto stavů, jako jsou chronická (rozšířená) bolest, chronická únava, poruchy paměti a deprese.
Detailněji se má za to, že k etiologii chronických únavových onemocnění přispívá dysregulace imunitního systému, která vyvolává změny v profilech cytokinů, hladinách imunoglobulinu a funkci T a B buněk a přirozených zabíječů (NK). Zejména u ME/CFS bylo popsáno několik imunologických abnormalit, včetně zhoršené cytotoxické funkce NK buněk a CD8 + T buněk, přítomnosti autoprotilátek zaměřených především na centrální nervový systém (CNS) a zvýšených hladin prozánětlivých cytokinů. Na vzniku bolesti a centrální senzibilizaci se podílejí také T buňky, což naznačuje, že patofyziologii FM ovlivňují četné subpopulace T buněk, včetně CD3 + T buněk, CD4 + pomocných T buněk a CD8 + cytotoxických T buněk.
Zvýšené hladiny systémových a neurozánětlivých markerů byly pozorovány jak u FM, tak u ME/CFS. Theoharides a kol. navrhli, že role žírných buněk jako „imunitní brány do mozku“, které mohou být stimulovány neuropeptidy, jako je substance P, o níž je známo, že je zvýšená v mozkomíšním moku (CSF) pacientů s FM, nebo pohlavními hormony, jako jsou estrogeny, možná vysvětluje zvýšené zastoupení žen u FM a CFS/ME.
U ME/CFS i FM se mitochondriální dysfunkce a snížená hladina ATP ve svalových a nervových buňkách přičítají rozsáhlé muskuloskeletální bolesti. Nerovnováha mezi oxidanty a antioxidanty byla spojena s těmito chronickými onemocněními, což podporuje roli oxidačního stresu při rozvoji a progresi těchto onemocnění. Morris a kol. předpokládali, že zvýšená hladina nukleárního faktoru kappa B (NF-kB), způsobující uvolňování prozánětlivých cytokinů, a snížená hladina tumor supresorového proteinu p53, způsobující aerobní mitochondriální dysfunkci, jsou klíčovými mechanismy u ME/CFS spojenými se zvýšenou produkcí reaktivních forem kyslíku (ROS), vyčerpáním mitochondrií a dodatečnou potřebou produkce ATP.
Nedostatek enzymu CoQ10, který byl zaznamenán jak u ME/CFS, tak u FM, může vést k mitochondriální dysfunkci kvůli snížené aktivitě mitochondriální respirace a mitochondriálního membránového potenciálu, což vede k produkci ROS a následně k selektivní degradaci mitochondrií zprostředkované autofagií, známé jako mitofagie. Autofagie je důležitý buněčný proces, který zahrnuje degradaci poškozených cytosolických složek lysozomy a zajišťuje rovnováhu energetických zdrojů. U FM a ME/CFS byly zaznamenány změny v autofagických genech nebo proteinech.
Stále více důkazů potvrzuje souvislost snížené cévní funkce u FM i ME/CFS. Endoteliální dysfunkce, která označuje abnormální funkci endoteliálních buněk, jež pravděpodobně vede ke snížené vazodilataci spolu se sníženou dostupností oxidu dusnatého (NO) (endotel-relaxační mediátor), je spojována se závažností příznaků těchto chronických onemocnění. U pacientů s ME/CFS byla ve srovnání se zdravými kontrolami pozorována snížená postokluzivní hyperemická odpověď branchiální tepny a kožní mikrocirkulace předloktí. Snížená průtokem zprostředkovaná dilatace brachiální tepny u pacientů s FM v reakci na zvýšený průtok krve nebo NO byla přisuzována nedostupnosti NO pro buňky hladkého svalstva, dysfunkci svalových buněk nebo neschopnosti tepen relaxovat.
S chronickou únavou souvisí také porucha iontových kanálů TRP. Iontové kanály TRP, aktivované receptory spřaženými s G-proteiny (GPCR), jsou neselektivní kationtové kanály, které mají vysokou propustnost pro vápník (Ca2+) a podílejí se na vstupu vápníku do zásob (SOCE) v bílé hmotě CNS, a jejich dysfunkce může vést ke snížené intracelulární mobilizaci Ca2+. Iontové kanály TRP, jsou citlivé na stresory, jako jsou viry, a mají klíčovou roli v regulaci signalizace Ca2+, která je důležitá pro buněčné funkce, intracelulární signální dráhy a buněčnou homeostázu.
Chronická rozšířená bolest byla popsána jako důsledek centrální senzibilizace, která je charakterizována zvýšenou a abnormální reaktivitou nociceptivních neuronů na různé podněty, což vede k narušenému zpracování bolesti v CNS. Dochází k aktivaci ionotropních N-methyl-D-aspartátových (NMDA), a-amino-3-hydroxy-5-methyl- 4-isoxazol-propionátových (AMPA) receptorů, podtypů metabotropních glutamátových receptorů (mGluR), neurotrofického faktoru odvozeného od mozku (BDNF), substance P a peptid spojený s kalcitoninem (CGRP), NO a bradykinin se podílejí na iniciaci a udržování centrální senzibilizační aktivity a přecitlivělosti na bolest. Také aktivace receptorů podobných Toll (TLR), jako je zvýšená signalizace TLR-4 v gliích a senzorických neuronech, se podílí na trvalém prozánětlivém stavu v míše a centrální senzibilizaci neuronů, což ovlivňuje nociceptivní dráhy, a tím vede k přetrvávající bolesti.
Centrální dysfunkce HPA se podílí na poruchách souvisejících se stresem, včetně ME/CFS a FM. U ME/CFS a FM bylo popsáno několik potenciálních mechanismů, které jsou základem hyperkortizolismu nebo hypokortizolismu, charakterizovaných vysokými, respektive nízkými hladinami cirkulujícího kortizolu (kortikosteroidů), které zahrnují uvolňování neurohormonů, kortikotropin uvolňujícího hormonu (CRH), a arginin vasopresinu (AVP) z hypotalamu, stimulaci jejich receptorů a vedoucí k uvolňování adrenokortikotropního hormonu (ACTH) z hypofýzy do systémové cirkulace, což ovlivňuje uvolňování glukokortikoidů z kůry nadledvin. Kortizol působí mechanismem negativní zpětné vazby, což způsobuje snížení sekrece CRH, AVP a ACTH. Během chronického stresu byla popsána trvalá aktivace osy HPA. Rovněž za chronických zánětlivých podmínek byl popsán posun aktivity HPA od dominance CRH k AVP.
Metabolismus tryptofanu zprostředkovává interakce mezi krví, mozkem a imunitním systémem. Tryptofan se odbourává methoxyindolovou cestou (1 %), což vede k produkci serotoninu (5-hydroxytryptaminu, 5-HT), nebo kynureninovou cestou (KYN) (> 95 %), která vede k de novo syntéze nikotinamidadenindinukleotidu (NAD+). V dráze KYN je tryptofan 2,3-dioxygenáza (TDO) stimulována kortizolem, zatímco indoleamin 2,3-dioxygenázy (IDO) jsou regulovány lipopolysacharidy a prozánětlivými cytokiny a snižovány antioxidanty a protizánětlivými cytokiny. Z metabolitů KYN je nejvíce neurotoxická kyselina chinolinová (QA), která snižuje hladinu NAD a působí jako agonista NMDAR, což způsobuje poškození neuronů a astrocytů zvýšením intracelulárního Ca2+. Kyselina kynurenová (KYNA) je neuroprotektivní; je produkována astrocyty a působí jako antagonista NMDAR. Dysmetabolismus tryptofanu cestou KYN a jeho metabolitů, především IDO, 5-HT, KYNA a QA, může přispívat k únavě, gastrointestinálním poruchám, depresi, neurozánětu, kognitivní dysfunkci, mozkové mlze, poruchám spánku a abnormalitám imunitního systému, které byly popsány jako společné příznaky ME/CFS a FM.
A konečně, metabolický syndrom a obezita jsou spojeny se závažností symptomů chronické únavové poruchy. Bylo zjištěno, že ženy s FM mají 5,5 krát vyšší pravděpodobnost metabolického syndromu a větší obvod pasu než zdravé ženy. U FM byla také popsána vysoká prevalence (17,3 %) nedostatku signalizace růstového hormonu (GH)/inzulinu podobného růstového faktoru 1 (IGF1) při obezitě. U žen s FM byly zaznamenány vyšší hladiny celkového cholesterolu a cholesterolu o nízké hustotě, stejně jako vyšší hladiny glykosylovaného hemoglobinu a triglyceridů v séru a vyšší hladiny poměru noradrenalinu (NE)/epinefrinu a NE/kortizolu v moči, což vede k vyššímu systolickému a diastolickému krevnímu tlaku. Metabolické profilování v plazmě pacientů s ME/CFS odhalilo změny v metabolismu mastných kyselin a lipidů, což ukazuje na poruchy v metabolismu taurinu a glycerofosfolipidů, mimo jiné v metabolismu mastných kyselin, a také v metabolismu purinů (ADP a ATP), pyrimidinů, aminokyselin, glukózy a oxaloacetátu.
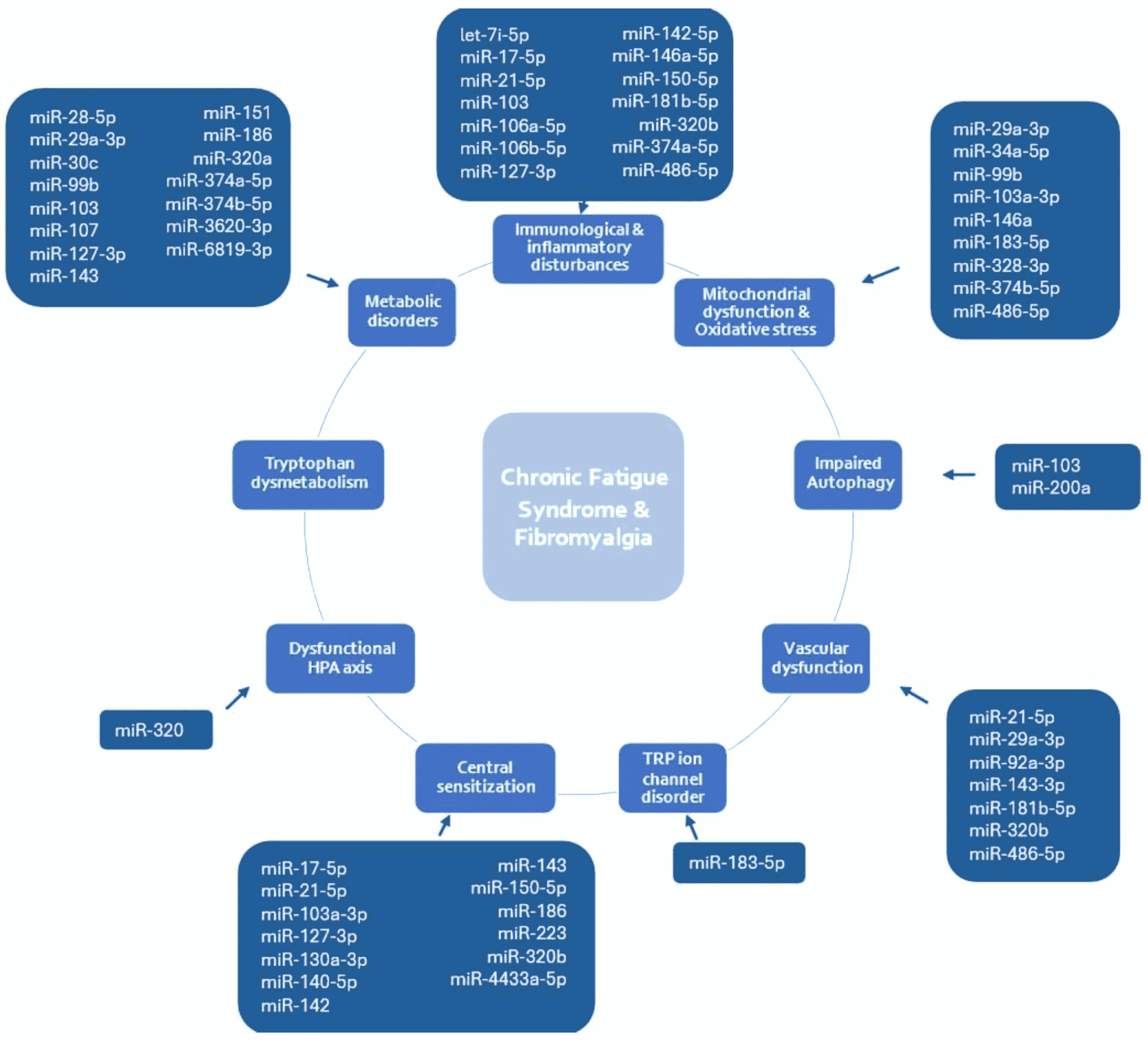
miRNA potenciálně zapojené do FM a/nebo ME/CFS
Řada přesvědčivých důkazů potvrzuje vliv změněné exprese miRNA na syndromy ME/CFS a/nebo FM. Na obrázku jsou znázorněny nejčastěji uváděné miRNA identifikované v nejméně dvou nezávislých studiích. U každého patofyziologického procesu je zvýrazněna miRNA.
Nejčastěji jsou zmiňovány v různých publikacích v souvislosti s podílením se na imunologických a zánětlivých poruchách u FM a/nebo ME/CFS miR-17-5p, miR-21-5p, miR-127-3p, miR-146a-5p, miR-150-5p a miR-320b. A miR-29a-3p, miR-34a-5p, miR-99b, miR-103a-3p, miR-146a, miR-183-5p, miR-328-3p, miR-374b-5p a miR-486 patří mezi nejčastěji zmiňované miRNA regulující mitochondriální dysfunkci a oxidační stres. Dysregulace miR-103 je nejčastěji spojována s autofagií a miR-21-5p, miR-143-3p a miR-320b s cévní dysfunkcí. Mezi nejčastěji studované miRNA zapojené do procesu centrální senzibilizace u těchto onemocnění patří miR-17-5p, miR-21-5p, miR-127-3p, miR-140-5p, miR-142, miR-143, miR-150-5p a miR-320b. Pokud jde o dysregulované miRNA u metabolických poruch u ME/CFS a/nebo FM, byly minimálně ve studiích identifikovány miR-127-3p, miR-374b-5p, miR-107, miR-143, miR-320a a miR-374b-5p. Bylo zjištěno, že pouze miR-183-5p se podílí na poruše iontových kanálů TRP a miR-320(a) na dysfunkční ose HPA u těchto bolestivých stavů, zatímco u ME/CFS a/nebo FM nebyla identifikována žádná miRNA, která by se podílela na dysmetabolismu tryptofanu.
Ukázalo se, že miR-152 reguluje většinu patologických procesů projevujících se u ME/CFS a/nebo FM, včetně imunologických a zánětlivých poruch, mitochondriální dysfunkce, oxidativního stresu, poruchy autofagie a vaskulární dysfunkce. U ME/CFS byla zaznamenána významně snížená exprese miR-152 v NK. Bylo prokázáno, že miR-152(-3p) reguluje chování podobné depresi vyvolané chronickou bolestí tím, že se zaměřuje na DNA metyltransferázu 1 (DNMT1).
U FM byla zaznamenána downregulace miR-23a. miR-23a se podílí na imunologických a zánětlivých poruchách, mitochondriální dysfunkci/oxidačním stresu, metabolických poruchách a vaskulární dysfunkci. Tato miRNA je členem klastru miR-23a-27a-24-2, který se podílí na mnoha onemocněních, včetně svalové atrofie prostřednictvím cílení na svalově specifický F-box protein (MAFx)/atrogin-1. Rovněž bylo prokázáno, že miR-23b (ze stejného klastru) reguluje expresi μ-opioidních receptorů a je nedostatečně exprimován u různých autoimunitních onemocnění prostřednictvím potlačení interleukinu 17 (IL-17), tumor nekrotizujícího faktoru α (TNF-α) nebo aktivace NF-kB vyvolané IL-1β.
U FM byla zjištěna zvýšená regulace miR-320a a snížená miR-320b. miR-320 podílí na regulaci osy HPA, mitochondriální funkce, oxidačního stresu, zánětu a metabolických poruch. miR-320 cílí na geny podílející se na poruchách bolesti, zejména vazbou na protein 5 vázající FK506 (FKBP5), který hraje důležitou roli v HPA ose a následně ve zpracování bolesti a stresové odpovědi. miR-320a reguluje neurozánět tím, že inhibuje své cíle, receptor pro transformující růstový faktor beta 2 (TGFBR2) a člena rodiny SMAD 2 (SMAD2), což vede ke zvýšení zánětlivých cytokinů, mitochondriální dysfunkci, apoptóze a oxidačnímu stresu. miR-320(a) je také zaměřen na receptor IGF-1 a/nebo IGF-1.
U FM je miR-103a-3p nedostatečně exprimována a souvisí s bolestí a množstvím spánku. U ME/CFS je exprese miR-103 v NK buňkách nižší. MiR-103(a) se podílí na imunitní zánětlivé odpovědi, mitochondriální dysfunkci a oxidačním stresu, poruše autofagie, centrální senzibilizaci a metabolických poruchách. MiR-103 je navržen jako terapeutický cíl, protože jeho downregulace vede k přecitlivělosti na bolest prostřednictvím regulace vápníkového kanálu typu L (na zvířecím modelu).
miR-29c-5p, miR-99b, miR-128-3p, miR-374b-5p a miR-766, se běžně podílí na metabolických poruchách a mitochondriální dysfunkci/oxidačním stresu.
miR-29c je členem rodiny miR-29, která hraje klíčovou roli v metabolismu a metabolických onemocněních a v mnoha dalších lidských chorobách. Zaměřuje se na geny svalové atrofie muscle RING-finger protein-1 (MuRF1), Atrogin-1 a histon deacetylázu 4 (HDAC4) a je spojován s velikostí a funkcí kosterního svalstva.
U ME/CFS je nadměrná exprese miR-99b v krvi a NK buňkách, to naznačuje signální dráhu mTOR a následně snížení cytotoxické a cytokinové efektorové funkce NK buněk.
U FM byla zaznamenána zvýšená regulace miR-128-3p. miR-128-3p potlačuje tvorbu kostní hmoty prostřednictvím sirtuinu 6 (SIRT6) a cílí na cholinergní systém u FM. Je také zapojen do reakce neuronů na oxidační stres.
miR-374b-5p se podílí na indukovaném vnímání bolesti a je nedostatečně exprimován u FM i ME/CFS. Zaměřuje se na vaskulární endoteliální růstový faktor A (VEGFA), který se podílí na vaskulogenezi a angiogenezi, jež regulují kapilární zásobení kosterního svalstva, a může tak souviset s malátností a únavou po námaze, jež se vyskytují u pacientů s ME/CFS a FM.
miR-766-3p je nedostatečně exprimován u FM. Reguluje více drah včetně apoptózy, extracelulární matrix a zánětlivé reakce u degenerace meziobratlové ploténky.
Vzorce specifické pro pohlaví a věk
U žen je přibližně 3x vyšší výskyt ME/CFS a 6x u FM.
Nejvíce reprodukovatelným rizikovým faktorem pro ME/CFS i FM je ženské pohlaví a zdá se, že míra výskytu se zvyšuje s věkem. Bylo prokázáno, že vnímání bolesti se u mužů a žen liší, přičemž ženy vykazují pozoruhodně nižší práh bolesti, což lze částečně přičíst jejich odlišným hormonálním profilům. Je pravděpodobné, že rozdíly v pohlaví ovlivňují hormony a imunitní reakce, mohou ovlivňovat také náchylnost k chronickým bolestivým stavům. Kromě toho se uvádí, že hormonální výkyvy během menstruačního cyklu a reprodukční fáze se rovněž podílejí na chronických bolestivých poruchách. Mezi gonadálními steroidními hormony bylo prokázáno, že estrogeny regulují nociceptivní dráhy a následně bolest prostřednictvím cílení na intracelulární receptory, jako jsou GPCR CNS a periferního nervového systému, a modulují serotonergní, noradrenergní, dopaminergní a endogenní kappa (k) nebo μ-opioidní dráhy. Estrogeny modulují syntézu a metabolismus serotoninu, jehož dysregulace je spojována s poruchami bolesti. Naproti tomu androgeny, které zřejmě inhibují expresi estrogenových receptorů působí, nociceptivní ochranný prostředek proti stresům. Nízké hladiny nadledvinových androgenů, zejména sérové koncentrace neurosteroidů a dehydroepiandrosteron sulfátu (DHEAS), byly pozorovány jak u ME/CFS, tak u FM. Ženy ve stavu s vysokým obsahem estradiolu vykazovaly sníženou citlivost na bolest, zvýšenou vazbu na mu-opioidní receptory v mozku a vyšší hladiny aktivované endogenní opioidní neurotransmise při bolesti, zatímco ženy ve stavu s nízkým obsahem estradiolu vykazovaly významně sníženou endogenní opioidní neurotransmisi spojenou s hyperalgezií.
Vedle pohlaví a/nebo genderu přispívá k onemocnění ME/CFS a FM také věk.
Byly popsány dva vrcholy výskytu ME/CFS, a to mezi 10 a 19 rokem a mezi 30 a 39 rokem. V jiné studii byl vyšší věk spojen s rizikem vzniku těžkého únavového syndromu, nikoli však s rizikem vzniku ME/CFS. U starších pacientů s ME/CFS bylo pozorováno vyšší skóre únavy ve srovnání s mladšími pacienty.
Vliv věku na rozvoj FM byl pravděpodobně přisuzován pozorovanému úbytku šedé hmoty, který byl naopak spojován s citlivostí na bolest. Bylo prokázáno, že u pacientů s FM docházelo v souvislosti s věkem k úbytku šedé hmoty 3,3 krát rychleji než u zdravých jedinců, přičemž každý rok trvání FM se rovnal 9,5 násobku normálního úbytku šedé hmoty při stárnutí. Kromě toho byl zvyšující se věk spojen s prodloužením doby trvání příznaků, ale se snížením příznaků FM. Zejména u starších pacientů s chronickými bolestivými stavy bylo zaznamenáno snížení bolestivých a depresivních příznaků ve srovnání s mladšími pacienty.
Závěr
Přestože bylo popsáno několik rizikových faktorů, patofyziologie, která je základem těchto syndromů, není dobře definována, což brání jejich přesné diagnostice a účinné léčbě. U obou onemocnění se objevuje mnoho dysregulovaných procesů. Lepší pochopení mechanismů, které se na těchto onemocněních podílejí, může vést k identifikaci biomarkerů, jako jsou některé miRNA, o nichž pojednává tento text. V tomto kontextu může být identifikace miRNA zapojených do těchto chronických onemocnění cenná pro včasnou diagnostiku FM a ME/CFS. Vyplnění této mezery může přispět nejen ke zlepšení kvality života pacientů, ale také budoucímu objevu léků na tato chronická onemocnění.
Co si z článku odnést:
Odchylky miRNA mohou posloužit jako biomarkery v diagnostice mnoha zdravotních stavů.
Odchylky miRNA rozliší onemocnění s podobným klinickým obrazem, jako je např. ME/CFS a FM.
